PENYAKIT REMATIK JANTUNG DENGAN DECOMPENSATIO CORDIS NYHA GRADE II
DATA PEMANTAUAN PASIEN
1. Identitas Pasien
Nama : An. RS
Umur/Tanggal lahir : 12,5 tahun/14 April 2012
Nomor RM : 376-xx-xx
Jenis Kelamin : Perempuan
Tanggal Masuk RS : 8 Oktober 2012
Berat Badan : 21 kg
Tinggi Badan : 136 cm
Ruang Perawatan : 110 E
2. Rincian Pasien
2.1. Keluhan Utama:
Sesak yang semakin memberat sejak 2 bulan sebelum masuk rumah sakit. (Rujukan dari RS Y dengan diagnose Decom Cordis ec Penyakit Jantung Rematik)
2.2. Diagnosis:
Recurrent attack of Rheumatic Fever on RHD
2.3. Objektif:
Compos Mentis, frekuensi nadi 80 kali per menit, frekuensi pernapasan 26 kali per menit, suhu 36,80C, tekanan darah sistolik 90 mm Hg dan diastolic 70 mm Hg.
3. Riwayat Pasien
3.1. Riwayat Pasien Sekarang
2 bulan sebelum masuk rumah sakit, sesak yang semakin memberat, demam (+), bengkak di sendi-sendi pergelangan kaki dan tangan, tidur dengan 2 bantal, tidak bisa berjalan [< 2 meter ‘ sesak (+)], intak (+) menurun, mual (+), muntah (+).
1 bulan sebelum masuk rumah sakit, keluhan sesak (+), semakin memberat, demam (+), batuk (+), pilek (+), bengkak (+) di wajah, nyeri sendi (-), BAK (+), BAB (+), intake (+) menurun, mual (+), muntah (-), kemudian dirawat di RS Abdul Muluk, dirawat 1 bulan mendapat BPG (Benasethine Penicillin G) 600.000 IU/21 hari, furosemid 2 x 20 mg, captopril 2 x 12.5, prednisone 3×3 tab kemudian di rujuk ke RS X.
3.2. Riwayat Penyakit Dahulu:
Riwayat batuk pilek sejak kelas 2 SD, berobat ke PKM (berulang)
Riwayat sakit berat (-)
3.3. Riwayat Penyakit dalam keluarga:
Penyakit rematik jantung disangkal
3.4. Riwayat Kelahiran:
Anak ke III dari IV bersaudara, lahir spontan di RS oleh dokter, berat lahir 3200 gram, panjang 48 cm, riwayat biru (-), riwayat kuning (-)
3.5. Riwayat Nutrisi:
Menurut keluarga, makan 3x sehari dan penurunan berat badan dalam 2 bulan terakhir 28 kg ‘ 21 kg
3.6. Riwayat Imunisasi:
Imunisasi dasar lengkap
3.7. Riwayat Tumbuh Kembang:
Riwayat tumbuh kembang sesuai dengan usia
3.8. Riwayat Pemeriksaan:
DPL tanggal 8/10/2012
Hb : 12.2
Ht : 38.9
Leukosit : 12.800
Trombosit : 424.000
MCV : 74.9
MCH : 23.11
MCHC : 31.7
Ureum : 30
Kreatinine : 0.63
Elektrolit : Na = 141, K=3.9, Cl : 111
LED : 11
Tanggal 8/10/2012
Echo : Severe MR, mild AR, PH
Tanggal 1/10/2012
Tes Autoimun
ASTO (Anti Streptolisin O) 735.0 IU/ml (nilai normal < 200)
CRP kuantitatif = 0.9 mg/L (nilai normal 0.0-5.0)
4. Hasil Pemeriksaan Laboratorium
4.1.1. Albumin : 4.00 g/dL
4.2. Bilirubin
Bilirubin Total 0.51 mg/dL
Bilirubin Direk 0.18
Bilirubin Indirek mg/dL 0.33
4.3. CRP 0.1 mg/L
4.4. Darah Perifer Lengkap
Hemoglobin 12.4
Hematokrit 38.2
Eritrosit 5.03
MCV/VER 5.9
MCH/HER 24.7
MCHC/KHER 32.5
Jumlah Trombosit 375.000
Jumlah Leukosit 14.370
Laju Endap Darah 5 .
4.5. Elektrolit
Natrium (Na) Darah (132 – 147 mEq/L) –> 134 & 133
Kalium (K) Darah (3.30 – 5.40 mEq/L)–> 3.89 & 5.05
Klorida (Cl) Darah (94.0 – 111.0 mEq/L) –> 91.5 & 92. Hs-CRP
hs-CRP 0.3 mg/dL
Pemeriksaan Penunjang lainnya
– Echocardiography. Hasil : Severe MR, mild AR, PH
– ASTO (Anti Streptolisin O) 735.0 IU/ml (nilai normal < 200)
– CRP kuantitatif = 0.9 mg/L (nilai normal 0.0-5.0)
5. Daftar Masalah
Recurrent attack of rheumatic fever on RHD
Acute gastritis ec steroid induce
Moderate malnutrition
Severe MR, mild AR, PH
Decompensatio Cordis NYHA grade III
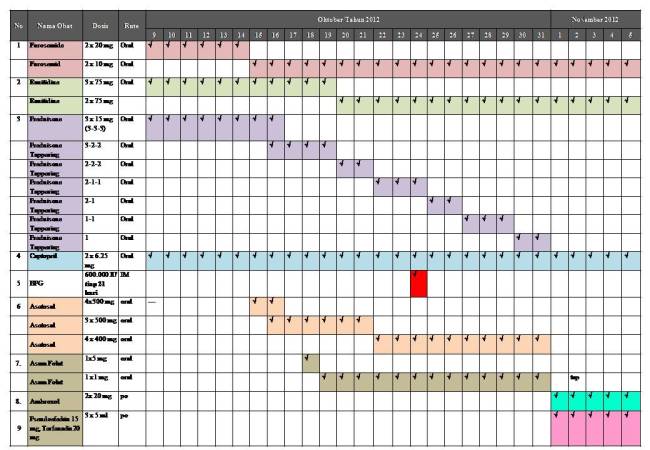
6. Profil Pengobatan
6.15. Furosemide
” Mekanisme kerja:
Menghambat reabsorbsi Sodium dan klorida pada ansa henle dan tubulus distal ginjal, mempengaruhi sistem transpor ikatan klorida sehingga dapat meningkatkan eksresi air, sodium, klorida, magnesium dan kalsium
” Indikasi:
Terapi untuk gagal jantung dengan cara mengurangi cairan, sehingga meringankan beban kerja jantung
” Dosis untuk anak-anak:
2 mg/kg/dosis setiap 6-8 jam/hari, dapat ditingkatkan 1-2 mg/kg/dosis dalam 6-8 jam hingga dicapai respon yang diinginkan. Maksimum dosis yang diperbolehkan untuk anak-anak adalah 6 mg/kg/dosis
” Cara pemberian:
Oral
” Efek samping:
Hipokalemia, hipotensi akut
” Paremeter monitoring:
Monitoring Input dan output setiap hari, tekanan darah, kadar elektrolit serum.
6.16. Ranitidine
” Mekanisme kerja:
Menghambat secara kompititif reseptor H2 pada sel parietal gastrik, yang menghambat sekresi asam lambung, volume gastrik, dan konsentrasi ion hidrogen dapat diturunkan oleh obat ini.
” Indikasi:
Terapi untuk mengatasi gastritis akut yang dialami pasien.
” Dosis untuk bayi dan anak-anak:
Untuk bayi dan anak-anak umur 1 bulan- 16 tahun
Treatment : 4-8 mg/kg BB dalam dosis terbagi 2x sehari. Maksimum 300 mg/hari
Maintenance : 2-4 mg/kg BB satu kali sehari, maksimum 200 mg/hari
” Cara Pemberian:
Diberikan secara oral
” Efek samping:
Konfusi, penurunan fungsi hati.
” Parameter monitoring:
Dilakukan pemeriksaan AST, ALT, serum kreatinine.
6.17. Prednisone
” Mekanisme kerja:
Menekan sistem imun dengan dengan menurunkan aktivitas dan volume limphatic system
” Indikasi:
Terapi untuk penyakit auto imun.
” Dosis untuk bayi dan anak-anak:
Untuk autoimmune hepatitis : 2 mg/kg BB/hari selama 2 minggu (maksimum 60 mg/hari) lalu ditappering off setelah 6-8 minggu 0.1-0.2 mg/kg/hari atau 5 mg/hari
” Cara pemberian:
Peroral
” Efek samping:
Gangguan pertumbuhan anak-anak, pheriperal edema, pusing dan sakit kepala.
” Parameter monitoring:
Hemoglobin, tekanan darah, serum potasium, berat dan tinggi badan pada anak-anak.
6.18. Captopril
” Mekanisme kerja:
Menghambat secara kompetitif angiotensin-converting enzyme (ACE), yang mencegah konversi Angiotensin I menjadi angiotensin II, vasokontriktor yang poten. Dengan kadar angiotensin II di plasma yang rendah maka aktivitas renin meningkat dan menurunkan sekresi aldosterone. Dengan vasokontriksi ‘ menurunkan beban kerja jantung
” Indikasi:
Untuk gagal jantung pasien
” Dosis untuk bayi dan anak-anak:
Inisiasi 0.5 mg/kg BB/hari, dapat dititrasi hingga maksium 6 mg/kg BB/hari terbagi dalam 2-4 dosis
” Efek samping:
Batuk kering, hipotensi, takikardia
” Parameter monitoring:
BUN, elektrolit, serum kreatinine, tekanan darah.
6.19. BPG (Penisiline G Benzathine)
” Mekanisme kerja:
Menghambat sintesa dinding bakeri sehingga dapat membunuh bakteri
” Indikasi:
Untuk mengatasi Group A Stappilococcus
” Dosis untuk bayi dan anak-anak:
Untuk demam rematik untuk anak yang < 27 kg 600.000 IU dan untuk anak >27 kg 1,2 juta IU setiap 3-4 minggu
” Efek samping:
Konfusi, ketidakseimbangan elektrolit, rash
” Parameter monitoring:
Elektrolit, hepatik, fungsi jantung dan fungsi hematologi.
6.20. Asetosal
” Mekanisme kerja:
Mengambat secara irreversible enzim siklooksigenase 1 dan 2 melalui asetilasi yang menyebabkan prekursor prostaglandin.
” Indikasi:
Sebagai antiinflamasi untuk mengatasi Group A Stappilococcus
” Dosis untuk bayi dan anak-anak:
60-100 mg/kg BB/hari diberikan setiap 4 jam.
” Efek samping:
Dapat menyebabkan Reye’s syndrome, hipetotensi, takikardia.
6.21. Asam Folat
” Mekanisme kerja:
Merupakan coenzime pada banyak proses metabolik, terutama untuk sitesis purine dan pirimidine, dan diperlukan untuk sintesis nukleoprotein, maintenance untuk eritropoesis, menstimulasi sel darah putih dan produksi platelet pada anemia defisiensi folat.
” Indikasi:
Untuk membantu mengatasi moderate malnutrisi
” Dosis untuk bayi dan anak-anak:
Untuk anak umu 9-13 tahun ‘ 300 mcg/hari
” Efek samping:
Reaksi alergi, erithema.
” Parameter monitoring:
Elektrolit, hepatik, fungsi jantung dan fungsi hematologi.
7. Analisa Pengobatan
7.1. Furosemide
Dosis untuk anak-anak:
0.5-2 mg/kg/dosis setiap 6-8 jam/hari, dapat ditingkatkan 1-2 mg/kg/dosis dalam 6-8 jam hingga dicapai respon yang diinginkan. (Maks : 6 mg/kg BB/hari)
Dosis menurut literatur : 21 kgx (0.5-2 mg/kg) = 10.05-42 mg
Dosis yang diberikan : 2×20 mg dan diturunkan menjadi 2×10 mg
DOSIS TEPAT
Efek samping yang termanifestasi pada pasien :
Hipokalsemia dan hipoklorida akan tetapi penurunan tidak signifikan
Monitoring efikasi:
Pasien mengalami perbaikan kondisi. Sesak berkurang, hanya ada ketika aktifitas berat. Sebelumnya, pasien mengeluhkan sesak meskipun dengan aktiftitas ringan maupun sedang.
Toleransi Balance cairan pasien juga baik
7.2. Ranitidine
Dosis untuk anak-anak:
2-4 mg/kg/dosis 2 kali sehari dan dapat ditingkatkan sampai 5 mg/kg BB dua kali sehari, maksimum 300 mg.
Dosis menurut literatur : 21 x (2 -4 mg)= 21-84 mg
Pasien diberikan 75 mg, dosis masih dalam range normal.
Tetapi, regimen obat 3x sehari, menurut literatur, ranitidine digunakan 2x sehari. Saran, sebaiknya Ranitidine diturunkan regimennya menjadi 2×75 mg/hari dan sudah dilakukan.
Efek samping: yang termanifestasi pada pasien :
Pwnurununan SGPT/AST penurunan tidak signifikan
Monitoring efikasi:
Pasien mengalami perbaikan kondisi. Nafsu makan pasien meningkat pasien tidak lagi mengeluhkan mual dan muntah
7.3. Prednisone
Dosis untuk bayi dan anak-anak:
Untuk antiinflamasi: 2 mg/kg BB/hari selama 6 minggu (maksimum 60 mg/hari) lalu ditappering off setelah 6-8 minggu 0.1-0.2 mg/kg/hari atau 5 mg/hari
Dosis literatur : 2 mgg/kg x 21 kg = 42 mg
Efek samping: yang termanifestasi pada pasien
Gangguan pencernaan
Monitoring efikasi :
Paisien merasa lebih baik, tidak terlihat adanya gangguan pertumbuhan, nilai potassium normal.
7.4. Captopril
Dosis untuk bayi dan anak-anak:
Inisiasi 0.5 -2 mg/kg BB/hari, dapat dititrasi hingga maksium 6 mg/kg BB/hari terbagi dalam 2-4 dosis
Dosis menurut literatur : 21 kg x (0.5-2 mg) = 10.5-84 mg/kg BB
Dosis yang diberikan kepada pasien adalah 2 x 6.25 = 12.5 mg
DOSIS TEPAT
Efek samping:
Tidak terdapat efek samping captopril
Monitoring efikasi:
Sesak berkurang, pasien merasa lebih baik.
7.5. Asetosal
Dosis untuk bayi dan anak-anak:
60-100 mg/kg BB/hari diberikan setiap 4 jam
Dosis seharusnya menurut literatur 60-100 mg/kg BBx 21
= 1260-2100 mg/hari
Dosis yang diberikan kepada pasien 3x 500 mg = 1500 mg
ᅭ DOSIS TEPAT
Efek samping obat yang termanifestasi pada pasien :
Terdapat kenikan nilai SGPT tapi tidak signifikan. Perlu pemantauan yang lebih ketat.
Parameter efikasi :
Kondisi pasien membaik
7.6. BPG
Dosis untuk bayi dan anak-anak:
Untuk demam rematik untuk anak yang < 27 kg 600.000 IU dan untuk anak >27 kg 1,2 juta IU setiap 3-4 minggu
Dosis yang diberikan = 600.000 IU TEPAT
Efek samping:
Tidak termanifestasi pada pasien
Monitoring efikasi :
Kondisi pasien membaik, sesak berkurang, keluhan berkurang
7.7. Asam Folat
Dosis untuk bayi dan anak-anak:
Untuk anak umu 9-13 tahun 500-1000 mcg/hari
Pasien mendapatkan 1 mg/hari Tepat DOSIS
Efek samping:
Tidak termanifestasi
Parameter monitoring:
Gizi mulai membaik
9. Pembahasan
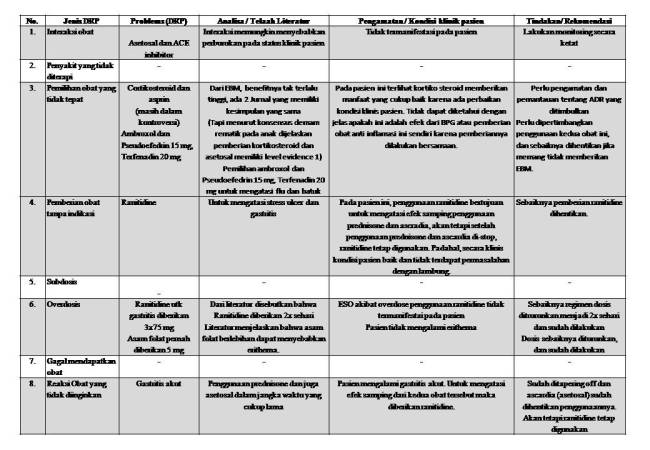
Pasien anak, perempuan, umur 12 tahun, masuk ke RS X dengan diagnosa PJT (penyakit jantung rematik) on RHD (Rheumatic Heart Disease) dengan Decompensatio cordis NYHA grade II. Pasien mengeluhkan sesak yang semakin memberat terutama 2 bulan sebelum masuk rumah sakit. Pasien kemudian berobat ke rumah sakit Y di Lampung. Pasien sudah diberikan BPG (Benzathine Penisillin G) intramuscular pada tanggal 3 Oktober 2012. Dan juga diberikan furosemide 2×20 mg untuk indikasi decompensatio cordis. Lalu, dirujuk ke RS X.
Pemeriksaan yang dilakukan terhadap pasien adalah test ASTO (Anti Streptolisin O) di mana diperoleh nilai 735.0 IU/ml (nilai normal < 200). Tingginya nilai ASTO ini menunjukan pasien mengalami demam rematik. Untuk itu, diberikan terapi BPG setiap 21 hari secara intramuscular. Pemilihan BPG ini sudah tepat sesuai dengan Consensus Guidelines on Pediatric Acute Rheumatic Fever and Rheumatic Heart Disease, 2008, di mana BPG merupakan first line untuk demam rematik. Dosis yangdiberikan juga tepat, di mana untuk anak dengan berat badan kecil dari 27 kg diberikan 0.6 juta IU.
Obat-obatan yang lain yaitu pemberian kortikosteroid (Prednisone) dan Asetosale untuk inflamasi pada demam rematik. Pemberian kedua obat ini sesuai dengan Consensus Guidelines on Pediatric Acute Rheumatic Fever and Rheumatic Heart Disease, 2008. Dosis yang diberikan dalam batas normal dan dosisnya dalam range yang diperbolehkan. Akan tetapi menurut EBM berdasarkan Cochrane database dalam jurnal pediatric cardiology; Anti-inflammatory treatment for carditis in acute rheumatic fever, 2012, dan juga dibahas oleh database Cochrane pada tahun 2009 dan 2003 di mana dijelaskan bahwa pemberian anti inflamasi tidak memiliki evidence manfaat untuk inflamasi yang disebabkan oleh demam rematik. Pada pasien ini, terdapat perbaikan kondisi klinis. Akan tetapi apakah ini disebabkan oleh penggunaan antiinflamasi atau penggunaan antibiotika BPG masih belum diketahui. Perlu dilakukan penelitian lebih jauh mengenai hal ini.
Penggunaan prednisone jangka lama ini memiliki efek merugikan yaitu gastritis yang termanifestasi pada pasien. Jadi, untuk mengatasi adverse effect, diberikan terapi ranitidine 3×75 mg dan kemudian diturunkan menjadi 2×75 mg. Hal ini merupapakn prescribing cascade. EBM penggunaan kortikosteroid masih kontroversi dan dari jurnal EBM yang bersumber dari Cochrane database menyatakan bahwa manfaat penggunaan steroid dinilai kecil maka sebaiknya penggunaan steroid untuk pasien ini perlu dipertimbangkan. Namun, ketika kasus ini dibahas, penggunaan prednisone sudah distop dan sedang dilakukan tapering off.
Ranitidine yang digunakan juga pernah melebihi dosis bagi anak-anak. Dosis yang dianjurkan pada literature adalah 2-4 mg/kg BB x 21 kg yaitu 42-84 mg. pasien diberikan 3x sehari. Dari literature, sebaiknya diberikan dua kali sehari saja dan dinilai sudah cukup. Pada pasien ini, penurunan regimen dosis ranitidine menjadi 2×1 sudah dilakukan.
Penggunaan Ranitidine pada tanggal 1-5 November 2012 merupakan terapi tanpa indikasi karena penggunaaan asetosale dan prednisone sudah dihentikan. Tidak ada indikasi penggunaan ranitidine. Pasien tidak mengeluhkan adanya nyeri lambung, hematemesis maupun melena. Pasien juga mengatakan tidak ada mual dan muntah serta penurunan nafsu makan. Jutru pasien mengalami perbaikan nafsu makan. Maka, penggunaan ranitidine setelah tanggal 1 November sebaiknya dihentikan.
Pemberian asam folat untuk malnutrisi pasien juga melebihi dosis untuk anak-anak. Dari literature disebutkan bahwa dosis untuk anak-anak umur 9-13 tahun adalah 500-1000 mcg/hari. Pasien diberikan 5 mg. Akan tetapi, permasalahan ini sudah dapat diatasi dan dosis sudah diturunkan menjadi 1 mg/hari. Tidak termanifestasi adanya eritema sebagai efek samping dari kelebihan dosis asam folat.
Penggunaan Captopril dan Furosemide untuk pasien ini atas indikasi Decompensatio Cordis NYHA grade II juga sudah tepat. Seperti yang dijelaskan dalam BNF for Children di mana dijelaskan bahwa pemberian ACE inhibitor memiliki nilai yang bermakna pada kejadian gagal jantung atau decompensatio cordis dan biasanya dikombinasi dengan loop diuretic. Dosis yang diberikan juga tepat. Perlu dilakukan monitoring kadar postassium tubuh mengingat penggunaan diuretik kuat dapat menyebabkan kehilangan kalium pada pasien. Adanya gangguan kalium akan semakin memberatkan kerja jantung yang juga sudah mengalami dekompensatio cordis. Pasien ini sempat mengalami hipokalemia, akan tetapi sudah mengalami perbaikan. Pasien mengatakan bahwa sesak akibat jantung yang bermasalah tersebut sudah jauh berkurang dan mengalami perbaikan. Pemilihan obat untuk gagal jantung di sini tepat dan pasien mengalami perbaikan. Namun, tetap perlu dilakukan pemantauan dan monitoring kadar elektrolit pasien selama penggunaan diuresis kuat. Perlu juga dilakukan Echokardiografi untuk memantau kondisi pasien.
Dari hasil echokardiografi tanggal 8 Oktober 2012, diketahui bahwa pasien mengalami mitral regurgitasi yang berat, aortic regurgitasi ringan dan hipertensi pulmonary. Dari jurnal Guideline for Diagnosis and Treatment of Pulmonary Hypertension,2009, dijelaskan untuk hipertensi pulmonary yang disebabkan oleh gagal jantung dan penyakit jantung bagian kiri, maka perlu dioptimalkan terapi penyakit utamanya. PH di sini tidak perlu diterapi. Hanya sebagian kecil studi yang menjelaskan tentang pemberian Sidenafil yang dapat meningkatkan outcome pasien dengan gagal jantung. Jadi, pemilihan untuk tidak dilakukan terapi dan fokus pada penyakit utama yang dilakukan terhadap pasien ini adalah tepat.
Pada awal bulan November 2012, pasien mengalami keluhan batuk dan pilek. Untuk itu diberikan Ambroxol dan Pseudoefedrin 15 mg, Terfenadin 20 mg. Pemberian kedua obat ini dinilai kurang tepat karena tidak ada EBM yang mendukung pemberian kedua obat ini pada anak. Maka, pemberian obat tersebut sebaiknya dipertimbangkan.
Secara umum, terdapat perbaikan klinis pasien dengan pemberian terapi seperti yang dibahas di atas. Namun, masih terdapat beberapa drug related problem yang perlu diselesaikan oleh farmasis klinis.
10. Kesimpulan
Dari kasus ini dapat disimpulkan bahwa :
1. Pemberian Captopril dan Furosemide adalah tepat sesuai dengan indikasi medis pada pasien ini.
2. Pemberian prednisone dan asetosal untuk penyakit jantung rematik masih dalam kontroversi. Dari guideline consensus, penggunaan kedua obat ini dianjurkan. Akan tetapi dari database EBM Cochrane, belum dapat ditemui evidence benefit penggunaan steroid maupun antiinflamasi yang ada saat ini.
3. Penggunaan BPG sebagai firstline terapi penyakit jantung rematik adalah tepat dan dosis yang digunakan juga tepat.
4. Ranitidine diberikan untuk mengatasi efek samping steroid dan NSAID akan tetapi masih tetap digunakan ketika penggunaan kedua obat tersebut dihentikan.
5. Penggunaan Pseudoefedrin 15 mg, Terfenadin 20 mg dan Ambroxol pada pasien pediatric kurang tepat karena tidak ada EBM yang mendukung.
6. Pulmonary hipertensi pada pasien tidak perlu diterapi sesuai dengan guideline untuk penyakit pulmonary hipertensi dan pada kasus ini sudah tepat.
11. Saran
Saran dari farmasis klinis adalah sebagai berikut :
1. Penggunaan Prednisone dan NSAID untuk pasien dengan penyakit jantung rematik perlu ditinjau ulang kembali, dan dari EBM Chochrane tidak ada evidence benefit yang kuat untuk pemberian steroid.
2. Penggunaan ambroxol dan Pseudoefedrin 15 mg, Terfenadin 20 mg sebaiknya dipertimbangkan dan dihentikan mengingat EBM pemberian kedua obat tersebut pada anak adalah lemah.
3. Pemberian Ranitidine adalah terapi tanpa indikasi untuk pasien ini, maka sebaiknya dihentikan penggunaannya.
4. Perlu dilakukan monitoring elektrolit pasien dan juga monitoring fungsi jantung secara berkala untuk menilai apakah ada adverse effect dan menilai efektifitas terapi.
DAFTAR PUSTAKA
Charles F. L, Lora L. A dan Morton P. G. Drug Information Handbook. 20th ed. USA: Lexi Comp; 2011. Hal 113-114, 291-292, 38-360, 1066-1068, 1640-1641.
Shann F. Drug Doses.15th ed. Australia: Intensive Care Unit Royal Children Hospital; 2010. Hal 6, 20, 37, 92.
Taketomo C. K, Hodding, J. H, dan Kraus, D. M. Pediatric Dossage Handbook.
17th ed. USA: Lexi Comp; 2010.
Galie N`, et al. Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur Respir J. 2009 (34): 1219-1263
Mishra,S. Consensus Guidelines on Pediatric Acute Rheumatic Fever and
Rheumatic Heart Disease. Indian Pediatrics J. 2008 (45) : 565-573
The Paediatric Formulary Committee. BNF for Children. BMJ Publishing. 2009.
Cilliers A et al. Anti-inflammatory treatment for carditis in acute rheumatic fever. Cochrane Database Syst Rev. 2012 Jun 13;6